乳酸代谢调节纳米系统协同铜死亡和铁死亡以增强癌症免疫治疗
作者:材料宝盒
铜死亡与铁死亡在抗肿瘤治疗中展现出显著的协同优势。谷胱甘肽(GSH)是调控这两种协同作用过程的关键分子,但其通过细胞固有的氧化还原稳态机制限制了治疗效果。2025年7月17日,同济大学董海青、李永勇团队在《Biomaterials》发表题为“Lactatemetabolismregulatingnanosystemsynergizescuproptosisandferroptosistoenhancecancerimmunotherapy”的研究论文,为解决这一难题提供了新方案。

该研究通过生物信息学分析与初步实验验证,发现乳酸代谢与铁死亡、铜死亡存在密切关联。基于此,研究团队创新性地靶向乳酸代谢,实现铜死亡与铁死亡的协同激活,并阐明了其背后的免疫治疗机制。研究构建了一种负载西罗辛普林(Syr)的纳米递送系统(Syr@mPDA@CP),以生物相容性介孔聚多巴胺(mPDA)为载体。当该系统靶向肿瘤组织时,释放的Syr可显著抑制乳酸外流,导致细胞内乳酸积累。而乳酸积累进一步诱导细胞内酸化,发挥双重作用:促进铁蛋白(FTH1)解离,释放内源性铁储存,提高细胞内铁水平;抑制糖酵解并降低ATP水平,使铜输出蛋白ATP7B失活,与过氧化铜(CP)衍生的Cu2+结合,协同放大细胞内铜积累。细胞内Cu2+和Fe2+浓度的升高可诱导双重细胞死亡途径,有效增强癌症免疫治疗效果。这一研究开创性地通过调节乳酸代谢,协同放大铜死亡与铁死亡效应,为抗肿瘤治疗提供了全新视角。
作为有效的非凋亡细胞死亡途径,铜死亡和铁死亡在克服癌症治疗耐药性方面潜力巨大。铜死亡由铜过量积累引发,会导致线粒体脂质化蛋白聚集并破坏三羧酸循环(TCA);铁死亡则是由过量脂质过氧化物引发的铁介导细胞死亡形式。尽管二者诱导机制不同,但通过线粒体代谢和谷胱甘肽(GSH)调节存在机制串扰。值得注意的是,联合激活两种途径诱导肿瘤细胞死亡的效果,强于单一途径靶向。
上述发现凸显了共激活铜死亡与铁死亡的治疗潜力,然而,铜和铁浓度不足、肿瘤微环境(TME)影响及细胞固有保护机制,严重限制了其疗效。因此,需克服这些挑战以实现高效的铜死亡和铁死亡诱导。目前,增强铜死亡和铁死亡的策略主要集中在GSH消耗和铜/铁外源性递送。GSH作为关键双重调节剂,通过GSH/GPX4轴抑制铁死亡,同时通过铜螯合抑制铜死亡,这种双重拮抗作用使GSH消耗成为增强二者协同抗肿瘤作用的有效策略。但GSH耗竭仍可通过细胞氧化还原稳态的补偿机制得到缓解,因此,迫切需要确定新的潜在共调节因子,以最大限度发挥协同治疗效果。
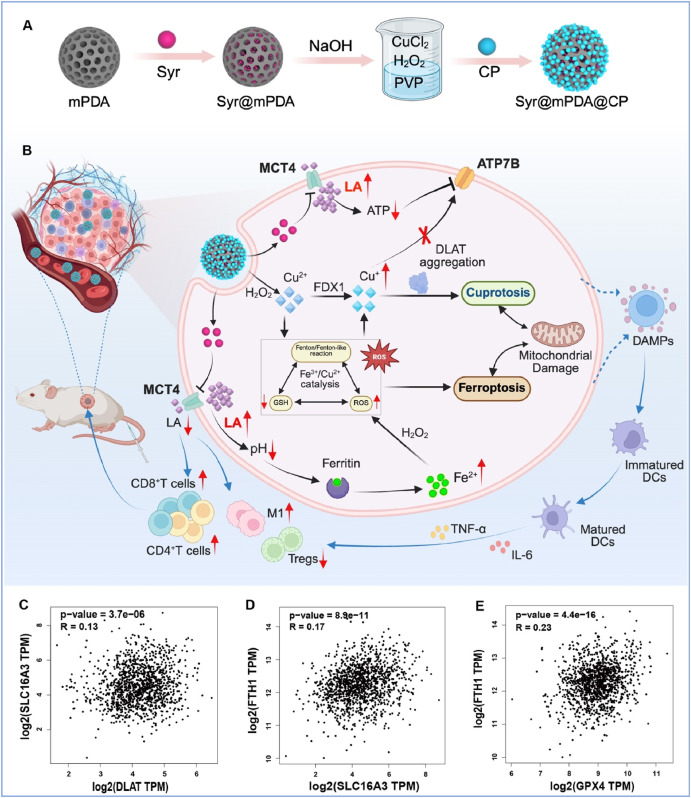
近期研究表明,乳酸代谢可能是铜死亡与铁死亡之间的关键连接点。高铜条件下,细胞内乳酸升高会使肿瘤细胞对铜超载更敏感;同时,酸性pH微环境可促进细胞内铁储存蛋白铁蛋白(FTH1)解离,释放内源性铁并增强铁死亡。鉴于单羧酸转运蛋白4(MCT4)介导的乳酸转运在维持细胞内pH值和乳酸稳态中起关键作用,研究团队假设靶向MCT4可同时增强两种细胞死亡途径。
对乳腺癌患者的生物信息学分析显示,MCT4表达与铜死亡(DLAT)和铁死亡(FTH1/GPX4)的关键标志物存在正相关关系,这在该研究的初步实验中得到进一步验证。上述发现表明,抑制MCT4可提高细胞内乳酸水平,诱导酸化及随后的铁释放(通过FTH1解离),同时增强铜死亡。此外,肿瘤微环境(TME)中乳酸积累会促进免疫逃逸,提示调节MCT4还可重塑免疫抑制环境。
为验证这一假设,研究团队开发了多功能纳米系统Syr@mPDA@CP,将MCT4抑制剂西罗辛普林(Syr)封装于介孔聚多巴胺(mPDA)中,并在其表面修饰过氧化铜(CP)。释放的西罗辛普林能显著抑制肿瘤细胞的乳酸外排,诱导细胞内酸化,促进内源性铁(FTH1)释放,从而提高细胞内Fe2+水平;同时,Syr@mPDA@CP负载的CP在酸性环境中分解,释放Cu2+,进一步增强Syr对铜输出蛋白(ATP7B)的抑制作用。由此产生的Cu2+和Fe2+水平升高,可协同加剧氧化应激,导致铜死亡和铁死亡。重要的是,这种双重激活会造成不可修复的线粒体损伤,进而增强免疫原性细胞死亡(ICD);同时,肿瘤微环境(TME)中乳酸的减少可重新编程肿瘤相关巨噬细胞(TAMs),减轻免疫抑制。因此,通过调节乳酸代谢,Syr@mPDA@CP能够同时激活铜死亡和铁死亡,重塑肿瘤微环境以增强免疫治疗。该方法不仅解决了单一疗法的局限性,还揭示了代谢调节与金属离子介导的细胞死亡之间的新联系。
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请多多包涵!